电话:16620112999 全天侯 值班手机号:13925129509(微信同号)
QQ:540013019
联系人:丁生、陈生
邮箱:xwdepo@163.com
地址:广州市白云区齐富路1号正阳大厦1709室/花都地址:新雅街临南河路6号之二702
请扫描下面的二维码咨询
【转载药智网】
2020-07-31,国家药监局综合司公开征求《药品上市后变更管理办法(试行)(征求意见稿)》意见。新规定下,制剂怎么进行批件转让?原料药是否可以进行批准证明文件转让?
1 药品上市后变更分类
药品上市后变更,分为“监管事项变更”和“注册管理事项变更”。这本身隶属于两个不同部门,现将相关工作程序结合在一份管理办法中,融合了《药品注册管理办法》和《药品生产监督管理办法》与上市后变更相关的规定。
2 技术转让相关规定废止
本规定自发布之日起施行,《关于印发药品技术转让注册管理规定的通知(国食药监注〔2009〕518号)》、《关于做好实施新修订药品生产质量管理规范过程中药品技术转让有关事项的通知》(国食药监注〔2013〕38号)废止。
3 持有人上市许可的“一拖二”模式
变更管理办法进一步明确了,“变更”和“新增”其实并不矛盾。不仅“一拖二”可以,“一拖多”也一样可以。
文件指出,变更生产单位包括:
变更委托生产单位;
增加委托生产单位;
持有人自行生产变更为委托生产;
委托生产变更为自行生产。
4 原“委托生产”改为向CDE申请
MAH“一拖多”虽然明确可以,但文件同时指出,凡涉及生产单位变更的(不是生产场地变更,而是生产主体变更),需要向药审中心申报补充申请,经审批通过后实施。
不禁让人眉头一紧,我们所说的“委托生产”,即新增委托生产单位。现需按如下程序申请:
1)完成生产许可证变更(持有人和受托生产单位双方);
2)按照有关变更技术指导原则要求完成研究,向药审中心提出补充申请;
3)药审中心应在规定时限内进行技术审评,根据审评需要组织现场核查和抽取样品进行检验;
4)批准后收回旧证,核发新的药品注册证书。
MAH大环境下,相关法规不仅没有“放宽”对新增、变更生产场地的审批,反而比原来更严了:原本属于省级局管理的“药品委托生产”,现需要向国家药审中心申请。
5 不变生产场地的持有人转让20工作日完成审批
前提是受让方的许可证变更已完成,向CDE提出不需要进行技术审评的补充申请,特别规定该类审批时限为20工作日。
该类转让批准后,还需要经过GMP符合性检查。
但是相对于其他有生产场地变更的持有人转让来说,已经是非常简约的了。
6 对受让方持有人的新要求
变更后的持有人应具备符合药品生产质量管理规范要求的生产质量管理体系,通过检查后方可上市销售药品。
但针对持有人进行GMP符合性检查,之前其他通告公告或征求意见稿没有提到,数月前征求意见的《药品上市许可持有人检查工作程序》所检查的范围也是多于GMP符合性检查的。
7 制剂怎么进行批件转让?
根据该征求意见稿,如有A企业将某药品上市许可及生产地址都转让给B企业,该如何申请?可推演该转让程序如下:
1)受让双方完成经过公证的转让合同;
2)受让方完成生产许可证变更;
3)向CDE申请变更持有人主体;
4)完成相关研究后,向CDE申请变更生产单位;
5)审批通过后,收回旧证,换新的药品注册证书;
6)通过GMP符合性检查。
这个过程相较于原来省局的“一站式”服务,显然有些繁琐。
8 原料药是否可以进行批准证明文件转让?
《药品生产监督管理办法》规定,经批准或者通过关联审评审批的原料药应当自行生产,不得再行委托他人生产。这意味着,从生产监督管理的层面分析,原料药的生产主体,是不可发生变更的。即,原料药批准证明文件不能进行转让。
虽然,按照化学药品药学变更指导原则最新征求意见稿,生产场地可以进行同一地址或不同地址的变更,并且不同地址的变更也只属于中等变更,但是,一旦涉及“主体不同”则性质就发生了变化。
简单来说,我们可以从一个生产地址搬到另一个生产地址,但是这两个地址都得是同一家生产单位的,如果两个地址属于两个不同的生产单位,则属于原料药生产企业变更,是生产监督管理办法所不允许发生的。
*该那如何“盘活”目前躺着不生产的原料药“批文”?
之前提供过几个可以考虑的思路:
1)原生产企业以技术服务方的身份,将该产品的相关技术给另一家生产企业重新申报;
2)实现“变更后的生产企业属于原生产企业”的条件;
3)原生产企业如果属于一家集团公司,该公司可以实现用同一套质量管理体系(这是关键),则可考虑将该产品重新申报时,以集团公司作为生产主体,这样今后若进行场地变更,该生产主体还有别的生产地址可供变更。
9 原料药可以申请什么变更,如何申请?
(1)原料药可以申请什么样的变更:仅限归注册事项管理的技术变更。
(2)什么样的原料药可以申请变更:关联审评审批平台登记状态标识为“A”或已与制剂一并通过关联审评审批的原料药。
(3)谁来进行变更申请:原料药登记人。
(4)如何进行变更申请:按照现行药品注册管理有关规定、技术指导原则及本规定确定变更类别经批准、备案后实施或者报告,相关信息应及时在登记平台更新。
【原料药变更管理原则】
关联审评审批平台登记状态标识为“A”或已与制剂一并通过关联审评审批的原料药发生技术变更的,原料药登记人应按照现行药品注册管理有关规定、技术指导原则及本规定确定变更类别经批准、备案后实施或者报告,相关信息应及时在登记平台更新。
变更实施后,原料药登记人应将变更情况及时通知相关持有人。持有人接到上述通知后应及时就相应变更对影响药品制剂质量的风险情况进行评估或研究,根据有关规定提出补充申请、备案或报告。
10 变更的程度判断是固定不变的吗?
不是的。变更的管理类别不仅可以调整,而且这事还可以商量,不拘泥于文字,不搞“本本主义”。一方面原因是,变更技术指导原则本身未能穷尽一切变更情形,另一方面原因是,持有人有时候无法确定变更管理类别,需要向省级局或CDE沟通。
持有人可以根据管理和生产技术变化对变更管理类别进行调整,并按照调整后的变更管理类别经批准、备案后实施或者报告。
其中,降低技术指导原则中明确的变更管理类别的,应与药品监管部门沟通并达成一致后实施。拟对重大变更降低管理类别的,应由省级药品监管部门转请药审中心协助明确变更管理类别,药审中心应在30日内答复。
11 变更持有人批准后原来的证书怎么处理?
药审中心批准持有人变更后,收回原药品注册证书,核发新的药品注册证书,同时对原生产工艺、质量标准、说明书及标签中的持有人或生产企业信息进行相应调整或在批准结论中注明,药品批准文号和证书有效截止日期不变。
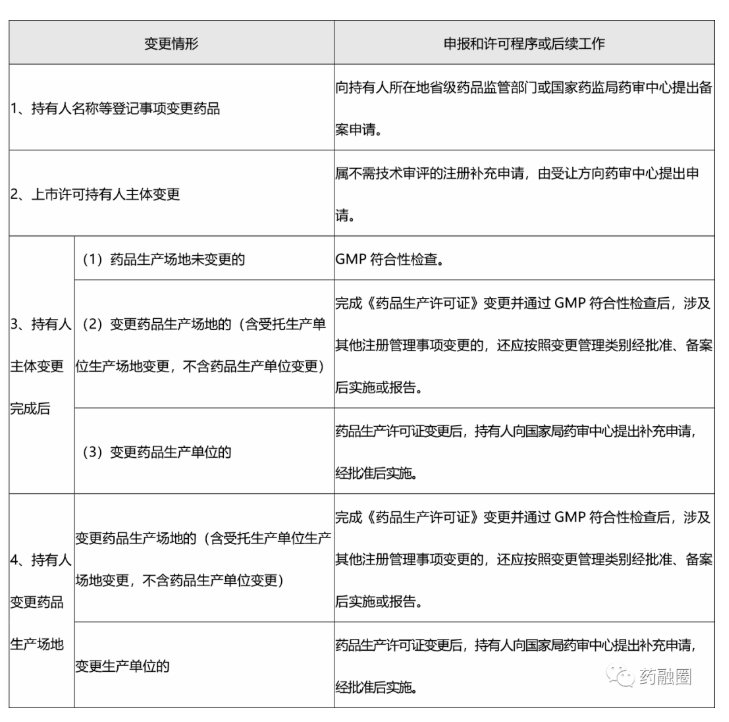
附:持有人变更申报和许可程序或后续工作
欢迎 你 发表评论: